人教版初三化学下册期末模拟试题
时间:60分钟满分:100分
可可以用到的相对原子水平:Na-23,Ca-40,Cl-35.5,C-12,H-1,N-14,O-16,Zn-65,
S-32,Ag-108
1、选择题
1.把少量的下列物质分别放入水中,充分搅拌后,可以得到溶液的是
A.面粉 B.沙土 C.汽油 D.氯化钠
2.儿童体内缺少钙元素,易患的疾病是
A.侏儒症 B.贫血症 C.甲状腺疾病 D.佝偻病
3.下列容易见到的生活物品中所含的主要材料,是有机合成材料的是
A.木桶 B.紫砂壶 C.不锈钢锅 D.橡胶汽车轮胎
4.健康的身体不能离开适当的饮食和健康的生活方法。下列说法错误的是
A.多吃富含维生素的蔬菜水果 B.倡导绿色出行,降低机动车辆废气排放
C.不抽烟,不沾染毒品 D.食盐中加碘,碘元素的摄入越多越好
5.对于下列生产、日常的反应,人民期望加快其反应过程的是
A.食物腐败 B.铁生锈 C.工业制纯碱 D.酸雨形成
6.运用图示法可以帮助大家巧学习化学。下列化学常识用相应图示表示正确的是
![]() ,A)
,A) ![]() ,B)
,B)
![]() ,C)
,C) ![]() ,D)
,D)
7.化学为大家解决能源、材料、粮食和环境问题,从而促进社会和谐进步。以下看法正确的是
A.煤、石油、天然气等化石燃料是可再生的,人类可以无限制的开发借助
B.农药和化肥能促进粮食生产,可以尽可能多用
C.塑料是合成材料,为大家的生活创造便利,但会导致“白色污染”
D.生活污水可以直接排入河流中
8.抽烟有害健康。烟燃烧产生的烟气中含有尼古丁。下列有关说法正确的是
A.尼古丁分子中含有氮分子 B.尼古丁的相对分子水平为162 g
C.尼古丁分子中碳、氢原子个数比为5∶7 D.尼古丁由碳、氢、氧三种元素组成
9.下列说法正确的是
A.向某固体上滴加稀盐酸,有气泡产生,则该固体肯定是碳酸盐
B.把燃着的木条插入某瓶无色气体中,木条熄灭,证明瓶中的气体是二氧化碳
C.取少量溶液于试管中,滴加氯化钡溶液,有白色沉淀生成,证明该溶液中肯定有硫酸根离子
D.不需要任何试剂就能把KOH、HNO3、CuSO4、MgCl2四种溶液辨别出来
10.下列除去杂质使用的试剂正确的是
A.H2—浓硫酸 B.CaO—稀盐酸
C.Cu—蒸馏水 D.NaOH—BaCl2溶液
11.下列各组离子在水中能很多共存的是
A.Cu2+、Na+、Cl-、OH- B.H+、K+、NO3-、SO42-
C.Na+、NH4+、NO3-、OH- D.Ag+、Ba2+、NO3-、Cl-
12.类推是一种要紧的学习技巧,但假如不具体问题具体剖析就会产生错误的结论。下列类推结论错误的是
①CO能与Fe2O3反应生成Fe,CO也能与CuO反应生成Cu
②NaOH溶液能使无色酚酞试液变红色,Cu2也能使无色酚酞试液变红色
③有机化合物含碳元素,则含碳元索的化合物肯定是有机化合物
④中和反应生成盐和水,但生成盐和水的反应可能不是中和反应
⑤碱的溶液呈碱性,则呈碱性的溶液肯定是碱的溶液
A.②③⑤ B.①②⑤ C.①⑤ D.③④⑤
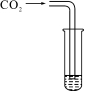
13.已知A、B、C、D、E五种物质中都含有人体含量最多的一种金属元素,其中A是单质,B、C含有两种元素,D、E含有三种元素,反应⑤是放热反应,它们之间的转化关系如图所示,下列推理不正确的是
A.E是碳酸钙 B.反应④肯定是中和反应
C.反应③可以由多个化学反应达成 D.反应②为吸热反应
14.在肯定水平的某NaCl溶液中加入足量的AgNO3溶液,所得AgCl沉淀水平等于原NaCl溶液水平的1/4。则原NaCl溶液中溶质的水平分数约为
A.40% B.30% C.20% D.10%
15.现有一包由3.2 g铜、13 g锌和2 g碳组成的粉末,放到适量的AgNO3溶液中,完全反应后得到的固体为m种,溶液中溶质为n种。下列说法中不正确的是
A.若m=2,则n=2或3 B.若固体中金属的水平为48 g,则m=4
C.当m=3时,溶液可能呈蓝色 D.反应后固体的水平不可能超越56 g
2、填空题
16.联系学过的化学常识,回答下列问题:
古时候“丝绸的道路”运输的产品有丝绸、陶瓷、铁器等,其中陶瓷是__________。
A.金属材料B.无机非金属材料C.复合材料D.有机高分子材料
活性炭能除去冰箱内的异味,这是借助活性炭的__________性;
碳酸氢钠可用作干粉灭火剂,灭火时,碳酸氢钠粉末受热生成碳酸钠和两种容易见到的氧化物,请写出该反应的化学方程式____________________△____________________________________________________________________________________________________,其基本反应种类为__________。
17.水是一种要紧的资源。请回答下列问题:
下列说法正确的是__________
A.硬水加入肥皂水容易起浮渣
B.日常常用煮沸的办法减少水的硬度
C.蒸馏水、矿泉水、纯净水等都是纯净物
D.自来水厂通过沉淀、过滤、吸附、消毒可将泉水变成纯水
氢气燃烧是大家认识水的组成的开始,该反应的化学方程式为________________________________________点燃______________________________。
水常用于灭火,其灭火原理是__________。
在通电条件下,水和氯化钠发生化学反应生成氢氧化钠、氢气和氯气,写出此反应的化学方程式______________________________通电____________________________________________________________。
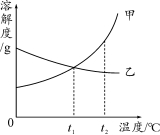
水是一种要紧的溶剂,甲、乙两种物质在水中的溶解度曲线如图所示:
①温度__________t1 ℃时,甲物质的溶解度大于乙物质的溶解度。
②t2 ℃时,用等水平的甲和乙分别配成饱和溶液所需要水的水平是甲__________乙。
③甲、乙两种物质的饱和溶液温度由t2 ℃降到t1 ℃时,溶液组成不发生改变的是__________。
18.依据碱的四条化学性质回答下列问题:

碱溶液能使酚酞溶液变__________色;
图中的X代表一类物质,则X为__________,请写出符合性质③的一个化学反应方程式__________________________________________________;
碱溶液都有相似化学性质是什么原因都含有____________________。
19.据统计,国内每年报废的手机超越1亿部,若不进行有效收购借助,会导致巨大的浪费和污染。某种手机电路板中含有以下金属:Sn、Pb、Fe、Cu、Au、Ag、Ni,Pd。下图是某工厂收购其中部分金属的步骤图。2CuSO4+2H2O)

步骤②中产生的气体是__________。
滤渣2中含有些金属是__________。
步骤⑤反应的化学方程式____________________________________________________________。
步骤⑥收购的纯净物B是____________________。
金属Fe、Ni、Pd在溶液中的活动性由强到弱的顺序依次是__________。
3、实验探究题
20.在2018年理化实验操作考试中,小刚同学选择了稀盐酸、氢氧化钠溶液、酚酞溶液三种试剂,按如图所示进行酸碱中和反应的实验。请回答:
试剂Ⅰ是__________,试剂Ⅱ是__________;
本实验中,常常使用酚酞溶液而不使用石蕊溶液做指示剂是什么原因__________;
欲验证上述实验中稀盐酸和氢氧化钠溶液是不是恰好完全反应,不可以选择的试剂是__________。
A.石蕊溶液B.铜片C.碳酸氢钠粉末
21.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组拓展探究活动。请你和他们一块完成以下实验探究。
【演示实验】将适量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是________________________________________________________________________________。
【查阅资料】CaC12溶液显中性。
【提出问题】实验中未察看到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
【猜想与假设】针对疑问,甲组同学猜想如下:
猜想I:只有CaC12
猜想II:有______________________________
猜想III:有CaC12和Ca2
猜想IV:有CaCl2、HCl和Ca2
乙组同学对以上猜想提出质疑,觉得猜想IV不合理,其理由是______________________________。
【实验探究】为了验证其余猜想,各小组进行了下列三个策略的探究。
实验策略 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
实验现象 | __________ | __________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca2 | 溶液中含有Ca2 | 溶液中含有Ca2 |
【得出结论】通过探究,全班同学一致确定猜想III是正确的。
【评价深思】丙组同学觉得滴加Na2CO3溶液产生白色沉淀,并不可以证明溶液中肯定含有Ca2,请你帮助他们说明缘由:______________________________________________________________________________________________________________。
在剖析反应后所得溶液中溶质的成分时,除去考虑生成物外,还需要考虑__________。
4、计算题
22.现有一家庭食用纯碱样品,其中含杂质氯化钠,为了测定样品中杂质氯化钠的水平分数,李明同学进行了三次实验。实验数据如下表:
编号 | 第1次 | 第2次 | 第3次 |
所取固体样品的水平/g | 15 | 12 | 12 |
加入氯化钙溶液的水平/g | 100 | 100 | 150 |
反应后生成沉淀的水平/g | 10 | 10 | 10 |
完成下列计算:
样品中氯化钠的水平分数;
加入氯化钙溶液的溶质水平分数;
恰好完全反应时,反应后所得溶液中氯化钠的水平分数。
解:设12 g样品中Na2CO3的水平为x,参加反应的CaCl2的水平为y,生成NaCl的水平为z
Na2CO3+CaCl2===CaCO3↓+2NaCl
106 111 100 117
x y 10 g z
100=10 gx=100=10.6 g
100=10 gy=100=11.1 g
117=zz=100=11.7 g
样品中氯化钠的水平分数为12 g×100 %≈11.7 %
加入的氯化钙溶液中溶质水平分数为100 g×100 %=11.1 %
恰好完全反应后溶液中氯化钠的水平分数为12 g+100 g-10 g×100%≈12.8%
答:样品中氯化钠的水平分数是11.7%;加入的氯化钙溶液中溶质水平分数为11.1%;恰好完全反应后所得溶液中氯化钠的水平分数是12.8%。